编者按:生物制药在全球范围内应用广泛,近年,在科技进步、临床需求、医保控费及市场的多因素推动下,生物制药仿制品——生物类似物在抗肿瘤、抗风湿等多个领域的研发迅速走红。随着我国集采呈常态化发展趋势,这股浪潮终将冲击到糖尿病用药领域。但新事物发展越是处于热潮时期,就越需要客观冷静的思考和判断,生物类似物与原研药物之间的距离到底有多远?类似是否等同?经典生物药品胰岛素及其类似物会被取代吗?糖尿病生物药品市场未来格局走向如何?知其然,需知其所以然... ...
一、从生物药品的复杂性看生物类似物的制备难点
生物药是指采用生物技术制备的治疗性生物制品,由体外细胞合成的、结构复杂且对理化因素敏感的、非均一结构的生物大分子混合物1。市场上常见的有胰岛素、生长激素、促红细胞生成素等。生物类似药则是指在质量、安全性和有效性方面与获准注册的原研药(参照药)具有相似性的治疗用生物制品2。
与化学药品相比,生物药品的分子量更大、结构更复杂,同时必须考虑免疫原性的问题3-6,因此整个制造过程极其复杂(图1)7-9。以门冬胰岛素30为例,其制剂工艺的主要难点在于,1)独特的胰岛素表达系统在原核与真核细胞中存在本质性区别,需进行充分验证10-14;2)生物药品的稳定性直接关系疗效和安全性,需要多种辅料在适宜条件下“排列组合”,才能兼顾门冬胰岛素的速效和稳定15-17;3)生产条件由门冬胰岛素和精蛋白门冬胰岛素的制备需求共同决定,同时还需确保比例保持稳定18-22。
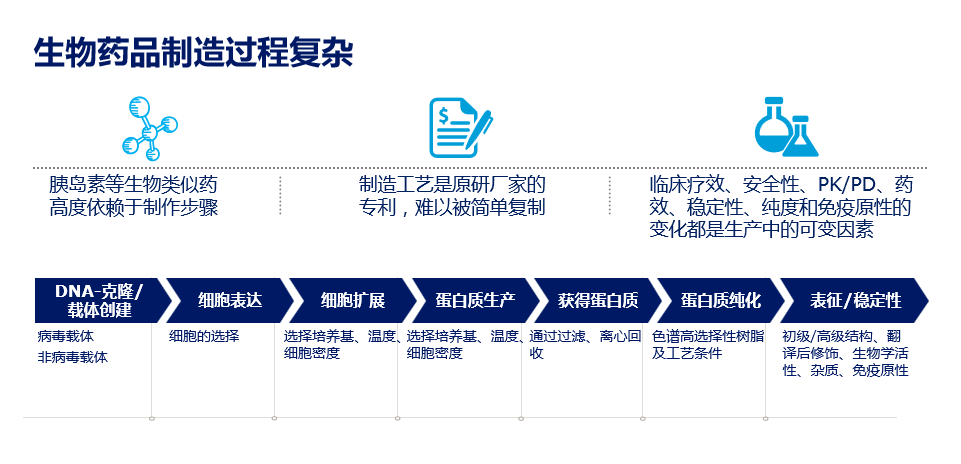
图1. 生物药品制造过程复杂
由于上述工艺的复杂性,生物药品的制剂和制备方法通常分别受专利保护23,进一步提高了生物类似物的研发门槛。
二、从药品全生命周期看生物类似物与原研之间的距离
研发、生产、流通、使用、监管是药品全生命周期的系列环节24。从研发角度来看,生物药难以像小分子化学药一样易于仿制并得到结构完全相同和均一的活性物质25,即使用最先进的仪器设备,也不能将其特性完全表征清楚,生物类似药注定不可能和原研药一模一样26-30,只能逐步递进地证明相似性(图2)31-32。从生产角度来看,工艺决定产出,生物药品的制造过程各有不同33,从而决定最终产品的性质仅能做到类似。
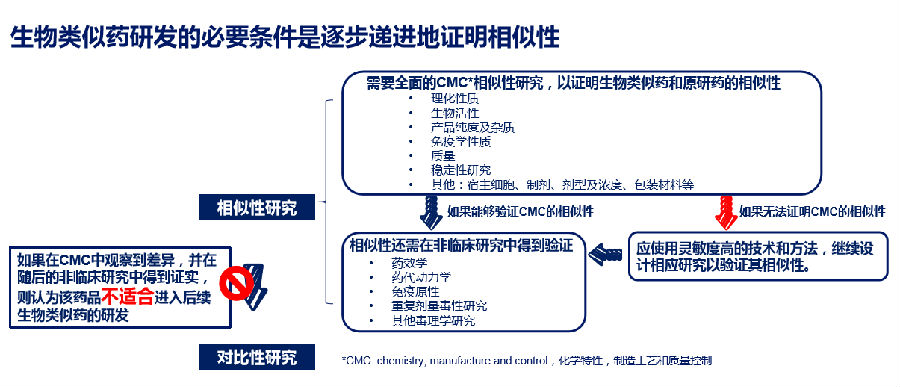
图2. 生物类似药研发的必要条件是逐步递进地证明相似性
从审批角度来看,我国生物类似药的研发起步较晚,相关的注册管理及配套政策尚在完善之中。2015年《生物类似药研发与评价技术指导原则(试行)》中首次明确,生物类似药注册的监管评估要求逐步递进证明药学相似、非临床相似、临床药理学相似(PK/PD)、安全性有效性相似(Ⅲ期临床试验)及免疫原性相似14。
从临床角度来看,生物类似物的临床疗效与认可度尚待进一步验证。据最新《中国生物类似药专家共识》34发布的“适应症外推原则”,生物类似药可获得参照药其他具有相同作用机制的适应症,一定程度上为临床疗效和安全性带来诸多不确定性。以胰岛素为例,在美国,既往使用原研胰岛素的2型糖尿病(T2DM)患者转换为生物类似药治疗后,胰岛素抗体阳性比例显著增加35;在英国调查研究中,半数以上医生对于换用生物类似药治疗仍缺乏信心36;亚洲横断面分析研究也发现,采用不同血糖指标评价时,非原研胰岛素与原研胰岛素的疗效比较结果不一致37;在我国,尚无胰岛素按照生物类似药的指导原则开发和获批。
三、一直被模仿,难以被超越的原研精品
原研生物药除了无法被复制,更难以被超越的是多年来积累的大量循证医学证据和丰富的临床应用经验。举个例子,门冬胰岛素30原研胰岛素在中国市场上市十余年,在中国及全球已打造出完善的循证证据体系,从药代动力学/药效动力学研究,到随机临床对照研究,以及在中国开展的A1chieve, Improve等等大型真实世界观察性研究,覆盖了从新诊强化到胰岛素起始及强化治疗方案,广泛覆盖胰岛素应用患者的各个病程阶段(图3)38。并且在2019年8月,国家医疗保障局发布的《国家基本医疗保险、工伤保险和生育保险药品目录》(2019版)中,为了优化药品费用结构,提高医保基金的使用效率,首次调整了医保目录时对其报销范围也相应拓宽为“限1型糖尿病患者和其他短效胰岛素”或“口服药难以控制的2型糖尿病患者”39。

图3. 举例:门冬胰岛素30丰富的循证证据体系
四、总结
基于现状用发展的眼光来看待糖尿病领域的生物药品应用,原研生物制品的循证医学证据体系完善,及时顺应医保改革方针,积极扩大药品可及性,未来必将惠及更多患者。
参考文献:
[1].曹萌, 等. 中国生物工程杂志. 2020;40(1/2):154-65.
[2].原国家食品药品监督管理总局. 食品药品监管总局发布生物类似药研发与评价技术指导原则[EB/OL].(2015-03-03)[2020-03-02]. http://www.nmpa.gov.cn/WS04/CL2168/329294.html.
[3].Amgen. Biologics and biosimilars – An overview. Amgen,;2017.
[4].Declerck PJ. GaBI J. 2012;1(1):13-6.
[5].Margarete Hannappel. AIP Conference Proceedings 1871, 060004 (2017); https://doi.org/10.1063/1.4996533
[6].Roger SD, et al. J Pharm Pharm Sci. 2007;10(3):405-10.
[7].Daller J, et al. Regul Toxicol Pharmacol. 2016;76:199-208.
[8].John White, et al. J Pharm Technol. 2019;35(1):25-35. Published online 2018 Sep 28. doi: 10.1177/8755122518802268
[9].Andrea Llano BSc (Hons), et al. PRACTICAL DIABETES. 2017;34(2):51-4. https://doi.org/10.1002/pdi.2079
[10].宋思扬楼士林. 生物技术概论(第四版)[M]. 科学出版社, 2014.1-332.
[11].Baneyx F, et al. Nat Biotechnol. 2004;22(11):1399-408.
[12].谢婷. 胰岛素前体在毕赤酵母中的分泌表达及其转变成人胰岛素[D]. 华东理工大学. 2008:1-54.
[13].F R Schmidt. Appl Microbiol Biotechnol. 2004;65(4):363-72.
[14].《生物类似药研发与评价技术指导原则(试行)》(2015年)https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200630175301552.html?type=pc&m=
[15].https://patentimages.storage.googleapis.com/ae/a1/85/7d3aa7a4101ce8/CN101060856B.pdf
[16].Brange J, et al. Adv Drug Deliv Rev. 1999;35(2-3):307-35.
[17].https://patentimages.storage.googleapis.com/ae/a1/85/7d3aa7a4101ce8/CN101060856B.pdf
[18].W W Fullerton, et al. Biochim Biophys Acta. 1970;214(1):141-7.
[19].K Yanagisawa. Hokkaido Igaku Zasshi. 1992;67(1):81-8.
[20].M R DeFelippis, et al. J Pharm Sci. 1998;87(2):170-6.
[21].S W Dodd, et al. Pharm Res. 1995;12(1):60-8.
[22].C M Yip, et al. Biophys J. 2000;78(1):466-73.
[23].http://pss-system.cnipa.gov.cn/sipopublicsearch/portal/uiIndex.shtml
[24].梅丹, 等. 中国药房. 2020;31(3):373-8.
[25].郭中平. 临床药物治疗杂志. 2020;18(5):1-6.
[26].Mc Kinnon, et al. BioDrugs. 2018;32(1):27-52.
[27].Lynne A Bui, et al. Drug Discov Today. 2015;20 Suppl 1:3-15.
[28].Ventola CL, et al. P T. 2013;38(5):270-87.
[29].Schellekens H, et al. NDT Plus. 2009;2(Suppl_1):i27-i36.
[30].US Congressional Budget Office. S. 1695 Biologics Price Competition and Innovation Act of 2007. US Congressional.
[31].Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues.
[32].GUIDELINES ON DEVELOPMENT AND EVALUATION OF BIOSIMILARS ( For Trial Implementation)10
[33].Lutz Heinemann, et al. Diabetes Sci Technol. 2011;5(3):741-54.
[34].https://www.cphi.cn/news/show-180970.html
[35].Hadjiyianni I, et al. Diabetes Obes Metab. 2016;18(4):425-9.
[36].Mohammed I Aladul, et al. Int J Pharm Pract. 2019;27(2):214-17.
[37].Linsey Gani, et al. J Diabetes Investig. 2018;9(6):1312-22.
[38].https://www.ncbi.nlm.nih.gov/pubmed
[39].《国家基本医疗保险、工伤保险和生育保险药品目录——西药部分》(2019版)