编者按:当考虑到自然和自然系统的需求时,“守护绿水青山”的可持续发展理念是绿色发展观的核心;当考虑到糖尿病和糖尿病治疗的管理目标时,“β细胞功能保护”是实现疾病缓解、资源可持续利用的重要基础。聚焦β细胞保护,应注重其他资源再生,即逆转β细胞去分化(促重塑)?还是遵循节约现有资源,减轻残余β细胞负担(减负荷)的策略?
一、促重塑:逆转β细胞去分化,促进“沉默”β细胞功能的恢复
胰岛β细胞功能受损和胰岛素抵抗是2型糖尿病发病的关键因素。过去,人们认为β细胞衰竭的主要原因来自于无法恢复且不可逆的细胞凋亡过程,但2017年ADA班廷奖得主Domenico Accili教授公布颠覆性发现:“去分化”可能是糖尿病个体β细胞功能减退的新机制。他认为高血糖并不会杀死β细胞,只是让其“保持沉默”,这些“沉默”的β细胞很可能“苏醒”和再分化,恢复其正常的生物活性1(图1)。
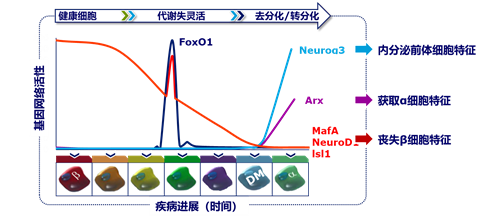
图1. T2DM进展中,β细胞去分化,转化为内分泌前体细胞或其他类型细胞
逆转去分化、改善胰岛β细胞的主要干预措施2,3,4包括:1)胰岛素强化治疗。糖尿病小鼠进行胰岛素强化治疗,可恢复有分泌功能的胰岛β细胞数量;细胞谱系示踪分析显示,胰岛素治疗带来的高血糖缓解,可以使发生了去分化的胰岛β细胞再次分化为成熟且具有分泌功能的β细胞。2)胃旁路手术。糖尿病大鼠进行胃旁路术,可恢复胰岛β细胞成熟分化特征性标志物的表达,改善β细胞的胰岛素分泌功能;3)其他治疗,比如GLP-1受体激动剂、IL-1β拮抗剂、GLP1 /雌激素靶向组合药物治疗等,在基础研究中展现出实现β细胞再分化的潜力;其他分子层面的方向还包括减少FoxO1活性缺失的过程可降低胰岛β细胞衰竭程度,通过基因治疗改善胰岛β细胞特征性转录因子表达等。
二、减负荷:减轻残余β细胞负荷,避免以增加内源性胰岛素分泌为代价
正常情况下,胰岛β细胞葡萄糖反应性胰岛素分泌,代谢需求改变,β细胞快速响应增加胰岛素分泌,加重β细胞负担5。胰岛素分泌无法满足代谢需求时,胰岛β细胞通过增殖代偿,如血糖进一步升高,胰岛β细胞受到持续性的糖毒性影响。因此可以看到,糖尿病状态下胰岛素释放信号通路发生障碍,胰岛素分泌受损6,7(图2)。
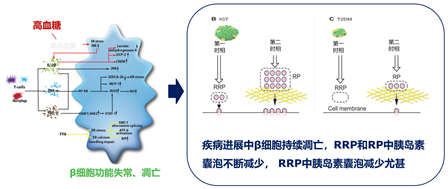
图2. 糖尿病状态下胰岛素释放信号通路障碍,胰岛素分泌受损
针对这一病理变化,常见的处理方式是延缓β细胞衰竭和模拟早相分泌,即“促泌”和“补充”。1)胰岛素促泌剂基于刺激胰岛素分泌机制改善早相分泌,包括磺脲类、肠促胰素等8,但由于对本就“负荷沉重”的β细胞进行持续刺激,反而可能加速β细胞衰竭。研究显示,磺脲类药物使胰岛β细胞凋亡增加了近3倍9。2)补充外源性胰岛素可一定程度改善β细胞胰岛素分泌受损情况,使β细胞充分休息,但仅能通过RP胰岛素囊泡转换作用于早相胰岛素分泌,不能完全为早相胰岛素分泌赋能6,7。
三、促重塑 or 减负荷?把握不同阶段主要矛盾,择时机早期干预
在决定干预策略之前,首先应明确不同疾病阶段的主要矛盾。新诊断患者胰腺中尚留存一定数量的胰岛β细胞,其中多数是静息或处于去分化状态非功能性的胰岛β细胞,并不分泌胰岛素。通过某些干预可以使其恢复合成并分泌胰岛素,通常把这些胰岛β细胞理解为"休眠的胰岛β细胞"。但随着糖尿病病程进展,胰岛β细胞功能受损,(新诊病程5年内的T2DM患者中高胰岛素血症占50%),导致T2DM不可逆转。10
可见保护β细胞功能应把握时机,尽早干预:
β细胞未到达数量减少、凋亡状态前,应解除高糖毒性,逆转去分化恢复胰岛素分泌,促进其他资源再生;
2)早期干预减少代谢需求,应减少对β细胞负荷,减少内源性胰岛素分泌,实现节约现有资源。
不同病阶段的β细胞功能状态不同,临床研究中常用的β细胞功能评估指标11包括HOMA-β等(图3),根据指标综合量化评估β细胞功能、准确判断是干预之前的关键步骤。

图3. 临床研究中常用的β细胞功能评估指标及意义
四、促重塑 or 减负荷?立足国人特点早期全面干预,择优而后选
根据β细胞功能的评估及可选的治疗方法,什么样的人群适合“促重塑”,什么人群适合“减负荷”?改善β细胞的干预措施包括药物、手术/移植、靶向基因调控等。综合多项研究12-19显示,新诊患者早期胰岛素治疗较其他方案更好改善β细胞功能,多数降糖药单药或联合短期治疗改善β细胞,缺乏长期治疗数据,孰优孰劣目前尚无定论。(图4)
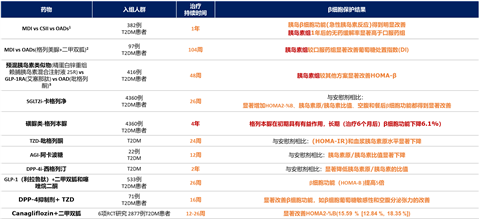
图4. 降糖药物治疗改善β细胞的证据
东西方人群T2DM患病风险及机制存在差异,中国糖尿病患者究竟如何择优?2020年发表的一项中国人群β细胞功能分析、横断面研究20或可解惑。
该研究纳入4792名从南京、成都、太原、洛阳4个城市的4所大学附属医院糖尿病专科招募的成年T2DM患者,利用电子病历收集参与者数据,并根据糖尿病病程(病程每间隔1年)的不同将参与者分为了21个组(<1年、1-2年、2-3年......>20年),利用HOMA 2模型[β细胞功能(HOMA-2β)和胰岛素抵抗(HOMA-2IR)]评估不同病程组参与者的β细胞功能,评价β细胞功能的年下降情况;利用多元线性回归模型评估可能会对β细胞功能的变化造成影响的因素。
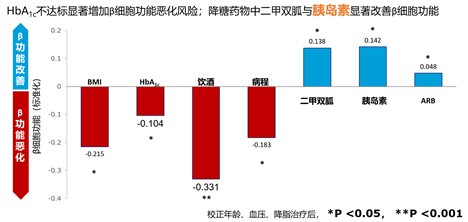
图5. 中国人群β细胞功能分析研究-研究结果(β细胞恶化/改善影响因素)
结果显示,1)基线时,我国患者血糖水平较高(HbA1c>9%);传统药物(二甲双胍、胰岛素)使用比例更高,新型药物使用比例较低;2)随糖尿病病程延长,β细胞功能和HbA1c水平均逐渐恶化;3)进一步分析发现,HbA1c不达标显著增加β细胞功能恶化风险,降糖药物中二甲双胍与胰岛素显著改善β细胞功能(图5)。
对于国人而言,促重塑、减负荷仍是β细胞功能保护的核心,应立足特点、兼顾基础和餐时的早期全面干预。
五、总结
2型糖尿病患者β细胞保护核心策略包括“促重塑”、“减负荷”,二者是分别针对促进其他资源再生、节约现有资源的“可持续管理”策略,对于不同病程患者的主要矛盾各有优劣,对于中国患者而言,应遵循以下原则:
把握时机——尽早强化治疗;
准确判断——综合量化评估β细胞功能;
择优而选——有明获益干预手段;
立足国人——早期干预,兼顾基础+餐时。
参考文献:
1. 内容出自Accili教授77thADA大会报告
2. Remedi MS, Emfinger C. Diabetes Obes Metab. 2016 Sep;18 Suppl 1:110-6.
3. 谭明红 魏平. 中国糖尿病杂志. 2017. 25(1):88-90.
4. Nat Metab . 2020 Feb;2(2):192-209.
5. Mol Metab. 2017 Sep; 6(9): 958–973.
6. Curr Diabetes Rev. 2013 Jan 1; 9(1): 25–53.
7. Seino S, et al., J Clin Invest. 2011, 121(6):2118-25.
8. Proc Jpn Acad Ser B Phys Biol Sci. 2010;86(6):563-77.
9. Maedler, K., et al.The Journal of Clinical Endocrinology and Metabolism 90(1):501e506.
10. 《缓解2型糖尿病中国专家共识》编写专家委员会. 中国全科医学, 2021, 24(32) : 4037-4048,F01.
11. 贾伟平, 等. 从基础到临床对胰岛β功能的评估. 中华内分泌代谢杂志 2005,21(4):4a1-4a2.
12. Weng J, et al. Lancet. 2008 May 24;371(9626):1753-60.
13. Chon S, et al. Diabetes Obes Metab. 2018 May;20(5):1121-1130.
14. Wen Xu, ET AL. Journal of Internal Medicine. 2015; 277(1): 137-50.
15. K Stenlf, etal. Diabetes Obes Metab . 2013 Apr;15(4):372-82.
16. Kahn, S.E, et al.The New England Journal of Medicine 355(23 2427e2443.
17. Zinman, B,et al.Diabetes Care 32(7):1224e1230.
18. Van Raalte, D.H.,et al.European Journal of Endocrinology 170(4):565e574.
19. Yang, T,et al.European Journal of Clinical Pharmacology 71(11):1325e1332.
20. Diabetes Metab Res Rev. 2020 Jun 8:e3364.