2019年中国因糖尿病及其并发症死亡的患者数达82万,其中33.4%的患者年龄<60岁[1]。由此可见,中国糖尿病防控形势日趋严峻,改善血糖管理刻不容缓。
中国2型糖尿病理生理主要特点:β细胞功能差、早相分泌减退明显
2型糖尿病的发生和发展中,最基本的病理生理改变是胰岛素分泌绝对或相对不足和/或靶组织对胰岛素敏感性降低。不同种族人群的胰岛素分泌和胰岛β细胞功能缺陷呈现不同特征。胰岛素分泌不足是中国2型糖尿病患者更突出的表现,且以早相分泌缺陷为主[2],血糖异常以餐后血糖升高为主要表现[3]。
研究发现,与西方人群相比,东方糖尿病人群的β细胞代偿储备功能更差,β细胞功能减退更明显,究其原因,可能与中国人遗传易感性相关[4]。研究显示,,中国2型糖尿病患者在前期早相分泌已受损严重,确诊时早相分泌指数已经下降到25%[5]。
中国2型糖尿病患者临床表现:餐后血糖高、餐后增幅大,应充分重视餐后高血糖的危害
胰岛素早相分泌缺失直接表现在患者的餐后血糖高、餐后血糖增幅大,并且早相胰岛素分泌水平越低,餐后2h血糖水平越高3。这可能与中国人的饮食特点有一定关系。近年来中国人群碳水摄入有所下降,但供能比仍高达67%[6-7],即使进食等量碳水化合物,中国人群的餐后血糖升高更明显[8]。流行病学调查显示,中国新诊断的2型糖尿病患者约80%以上伴有餐后血糖升高,平均餐后血糖增幅可达5~7mmol/L [9]。
餐后高血糖通过多重机制驱动糖尿病并发症的发生及进展[10]。
餐后高血糖与糖尿病微血管并发症发生的风险增高相关。可能的机制是快速升高的餐后血糖(PPG)造成血糖波动,导致血管内皮功能下降、血管反应性增加。
餐后高血糖与糖尿病大血管并发症发生的风险增高相关的机制可能与血糖波动有关。急性血糖升高会快速抑制内皮型一氧化氮(NO)释放及内皮依赖性血管扩张,增加可溶性粘附分子水平,并可能促进血栓形成。急性血糖波动比慢性持续性高血糖更显著地促进氧化应激反应和损害内皮功能[10]。
餐后高血糖升高渗透压,可增加血小板反应性,激活血小板,参与餐后高凝状态,减少心肌血容量及心肌血流10。以上这些机制均直接参与糖尿病并发症的发生和发展。
一项基于中国人群的大规模前瞻性队列研究(中国心脏代谢疾病及肿瘤队列研究,简称4C研究)显示餐后2小时血糖对糖尿病及其并发症的独立危险因素,有重要预测价值。当餐后2小时血糖>11.1mmol/L时会使心血管疾病、癌症风险和全因死亡风险分别增加30%、44%和58%[11]。(见图1)
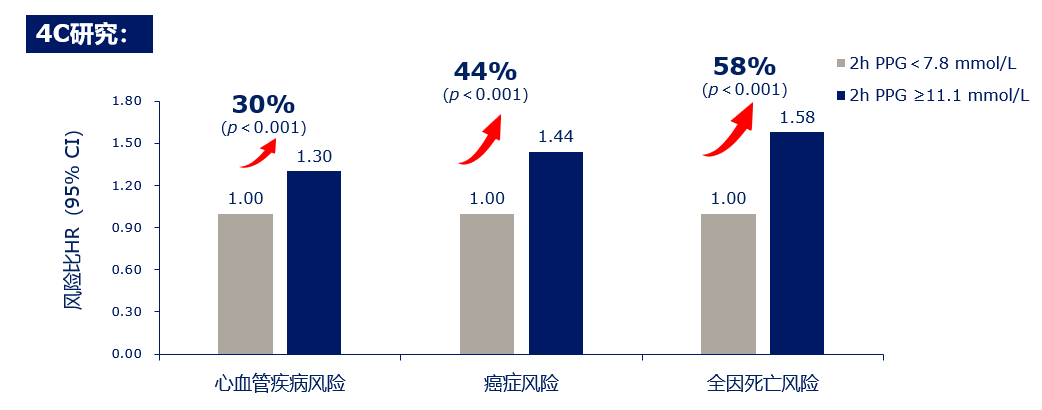
图1
因此,中国糖尿病患者在选择治疗方案的时候应该兼顾空腹和餐后血糖控制,在临床对于患者门诊复诊时,除了检测空腹血糖以外,检测餐后2小时血糖亦十分重要。
实现血糖达标,预混胰岛素方案助力中国2型糖尿病患者“双相赋能”
早期良好的血糖控制可以带来良性“代谢记忆”效应,有助于预防或延缓2型糖尿病患者并发症尤其是微血管并发症的发生发展。研究显示,同时兼顾空腹和餐后血糖能够有效改善新诊患者的胰岛β细胞功能[12]。
2020年2月,中华医学会糖尿病学分会(CDS)和中华医学会内分泌学分会(CSE)共同发布了最新版的《中国成人2型糖尿病患者糖化血红蛋白控制目标及达标策略专家共识》[13]。共识强调2型糖尿病患者应关注血糖、尤其是糖化血红蛋白的达标,再次认可HbA1c在临床上作为评估长期血糖控制状况的金标准,在糖尿病的管理中具有重要价值。共识推荐将一般成人2型糖尿病患者HbA1c的控制目标定为<7.0%,可兼顾大血管、微血管获益与发生不良事件(低血糖、体重增加)风险之间的平衡。而对于年轻、病程较短、预期寿命长、无并发症、不合并心血管疾病的2型糖尿病患者,推荐HbA1c控制目标为<6.5%甚至接近正常。
控制血糖是降糖理念的核心,胰岛素是血糖管理最有效的武器。在2017版中国2型糖尿病防治指南提供了各类口服降糖药、胰岛素的降糖能力参考依据,主要是以降低糖化血红蛋白(HbA1c)的幅度作为一个综合评估。胰岛素、二甲双胍、磺脲类、胰高血糖素样肽-1受体激动剂降低HbA1c的幅度分别为1.5-3.5%,1.0-2.0%,1.0-2.0%,0.5-1.6%,都属于强效降糖药物,其中胰岛素降低HbA1c的幅度最大[14~16](见图2)。
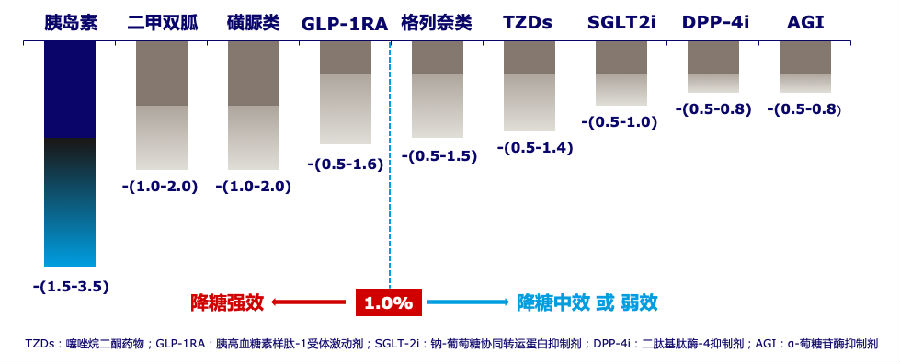
图2
所以,2017版中国2型糖尿病防治指南A级推荐:2 型糖尿病患者在生活方式和口服降糖药联合治疗的基础上,若血糖仍未达到控制目标,应尽早(3个月)开始胰岛素治疗。
基于中国2型糖尿病患者病理生理特点,在生活方式和口服药控制不佳的患者中,尽早起始胰岛素,尽早治疗达标是目前最有效的方法之一,符合中国2型糖尿病患者需求的起始治疗方案应该能够双相补充、满足高碳水饮食的个体化需求、兼具安全性和经济性等特点。
门冬胰岛素30由70%的精蛋白门冬胰岛素和30%门冬胰岛素组成。一项荟萃分析显示,对于口服降糖药血糖控制不佳的2型糖尿病患者加用门冬胰岛素30或者甘精胰岛素强化治疗,门冬胰岛素30较甘精胰岛素治疗后,可以获得更好的HbA1c下降且不增加重度低血糖风险[17](见图3)。
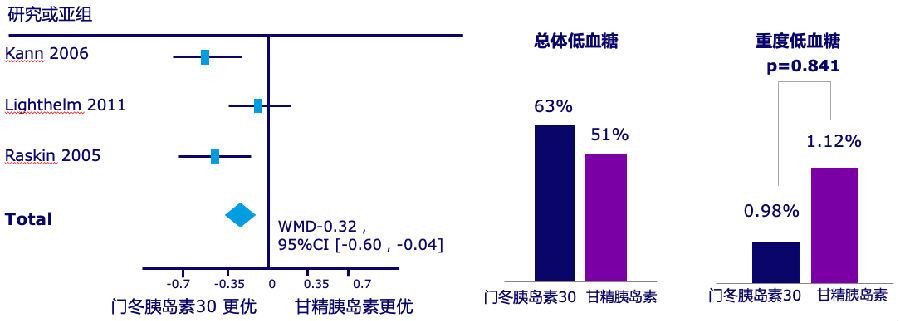
图3
基于OnceMix和INITIATE研究,对来自中国临床起始应用胰岛素治疗的2型糖尿病患者数据,采用CORD糖尿病模型进行分析结果表明:相对于基础胰岛素,门冬胰岛素30不仅成本低,且患者并发症累积发生率低,延长了患者的生存期。[18](见图4)
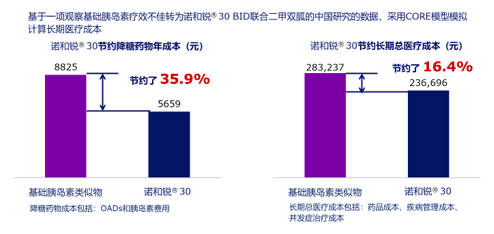
图4
门冬胰岛素30不仅在胰岛素起始治疗方面优势明显,在优化胰岛素治疗方案方面也被认可。2018年《2型糖尿病起始胰岛素后方案转换的临床指导建议》指出:对于基础胰岛素治疗6个月效果不佳的患者,空腹血糖达标,但 HbA1c ≥7.0%;或者餐后血糖增幅>3mmol/L;基础胰岛素日剂量超过0.4~0.6U/kgd的患者,“双相赋能”胰岛素方案,推荐优化为门冬胰岛素30BID治疗。
总结
在特有文化背景和饮食结构下,我国糖尿病患者餐后血糖增幅显著高于西方人群。其所需要的胰岛素方案应满足同时覆盖空腹和餐后血糖、血糖波动小、控制更平稳、方案简单、易于操作、经济等特点。门冬胰岛素30同时控制空腹和餐后血糖,给药简便更易依从,药物及整体医疗治疗成本较低,是符合中国2型糖尿病患者血糖管理需求的治疗利器。
参考文献:
[1]2019 年 IDF 全球糖尿病地图(第九版)
[2]Yabe D, et al.Curr Diab Rep. 2015 Jun;15(6):602.
[3]Del Prato S. Diabetologia. 2003 Mar;46 Suppl 1:M2-8.
[4]Kodama K, et al. Diabetes Care. 2013;36(6);1789-96.
[5]JIA Wei-Ping, et al. Chinese Medical Journal.2008; 121(21):2119-2123.
[6]He Y, et al. Lancet Diabetes Endocrinol. 2019; 7 (7): 540-548 ;
[7]Dehghan M, et al. Lancet. 2017;390(10107):2050-2062.
[8]Kataoka M, et al. Diabet Med. 2013;30(3): e101-7.
[9]Yang W, et al. N Engl J Med. 2010;362(12):1090–101.
[10]中国2型糖尿病患者餐后高血糖管理专家共识 [J]. 中国糖尿病杂志. 2016;24(5):385-392.
[11]Lu J, et al. Diabetes Care. 2019 Aug;42(8):1539-1548.
[12]Weng J, et al. Lancet. 2008 May 24;371(9626):1753-60.
[13]中国成人2型糖尿病患者糖化血红蛋白控制目标及达标策略专家共识,中华内分泌代谢杂志,2020,36(01): 14-24.
[14]Nathan DM, et al. Diabetes Care 2009;32:193-203.
[15]中国2型糖尿病防治指南(2017年版)中华糖尿病杂志,2018,10(1) 4-67.
[16]Garber A, et al. Lancet. 2009 Feb 7;373(9662):473-81.
[17]Rys P, et al. Int J Clin Pract. 2014 Mar;68(3):304-13.
[18]Gao Y, et al. Diabetes Ther (2018) 9:673–682.